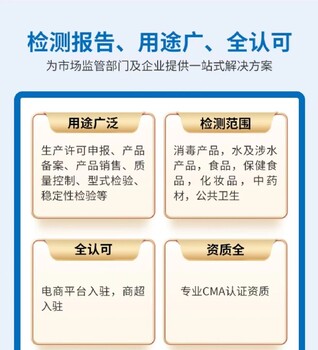
消字號產品備案流程主要包括以下幾個步驟: 1. **確定產品性質**:,需要明確產品是屬于抗產品還是消毒產品。這是備案流程的步,對于后續的操作具有重要的指導作用。 2. **成分審核**:在確定產品性質后,需要對產品的成分進行詳細的審核。這一步主要是確保產品成分符合國家標準,特別注意不能添加西藥和激素成分。成分審核是備案流程中的關鍵環節,直接關系到產品的安全性和合規性。 3. **資料起草**:根據產品的基本信息和成分審核結果,起草消字號產品的相關資料。這些資料將作為消字號檢測的依據,因此準確、完整。 4. **樣品送檢**:在資料起草完成后,需要準備樣品并送檢至相關檢測機構。消字號檢測周期一般為3-4個月,期間將對樣品的各項指標進行全面的檢測。 5. **備案安全評估報告**:在樣品檢測合格后,需要編制備案安全評估報告。這份報告將詳細評估產品的安全性和有效性,是備案流程中的重要文件。 6. **網絡備案**:后,將相關資料和安全評估報告提交至國家市場監督管理總局(或原國家衛生部門)進行網絡備案。備案成功后,產品即可獲得消字號認證,并可以在全國消毒產品查詢平臺上進行查詢。 此外,在整個備案流程中,還需要注意遵循相關的法律法規和標準要求,如《消毒產品標簽說明書管理規范》等。同時,為了提高備案效率和成功率,企業可以選擇的代理機構進行代理辦理。代理機構通常具備豐富的知識和經驗,能夠為企業提供全面的咨詢和支持服務。 總的來說,消字號產品備案流程是一個復雜而嚴謹的過程,需要企業投入足夠的時間和精力進行準備和操作。通過遵循正確的流程和要求,企業可以順利獲得消字號產品備案,并確保產品的安全性和合規性。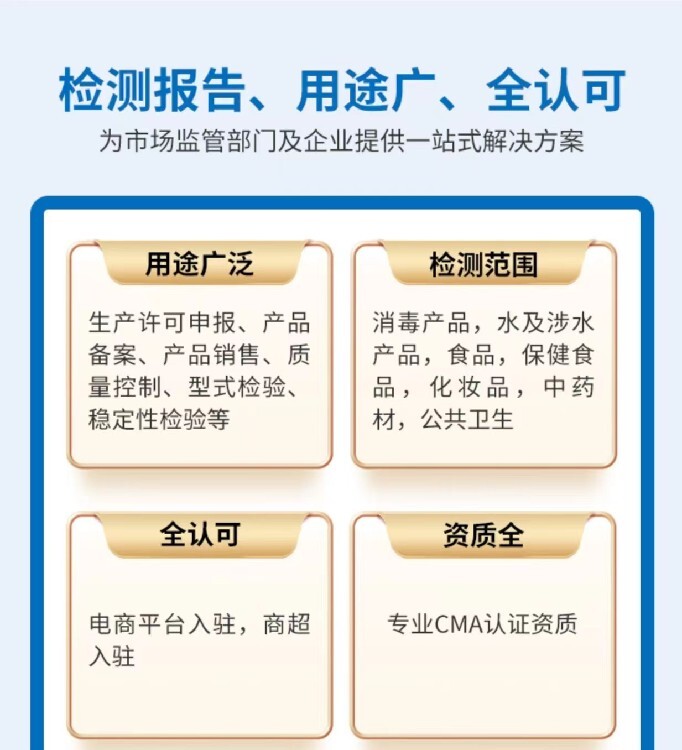
辦理消毒劑檢測報告的流程一般包括以下步驟: 1. **聯系檢測機構**: - 客戶需要與檢測機構進行聯系,可以通過電話、網絡等方式提交檢測需求,并了解詳細的檢測項目和流程。 2. **提交檢測樣品**: - 客戶需要按照檢測機構的要求,提供真實有效的消毒劑樣品。樣品應包裝完整,并標注清晰的產品信息。 3. **填寫檢測申請表**: - 在檢測機構的指導下,客戶需要填寫檢測申請表。申請表中應詳細描述檢測項目、樣品信息以及其他相關要求。 4. **初檢與報價**: - 檢測機構收到樣品后,會進行初步檢測,以確定樣品的性質和檢測難度。初檢期間,檢測機構還會為客戶制定詳細的實驗方案。 - 初檢完成后,檢測機構會根據檢測項目以及實驗的復雜程度進行報價。客戶需要確認報價并支付相應的檢測費用。 5. **簽訂協議**: - 在開始正式實驗之前,檢測機構會與客戶簽訂保密協議,以確保客戶隱私和實驗數據的安全。 6. **開始實驗**: - 簽訂協議后,檢測機構會按照實驗方案開始進行正式的檢測實驗。實驗過程中,檢測機構會嚴格遵守相關法規和規定,確保實驗結果的準確性和可靠性。 - 實驗的完成時間會根據具體情況而定,一般可能在5-10個工作日內完成。如果客戶需要加急處理,可以與檢測機構協商縮短實驗周期。 7. **領取檢測報告**: - 實驗完成后,檢測機構會出具詳細的檢測報告。客戶可以到檢測機構領取報告,或者通過電子郵件等方式接收電子版報告。 - 檢測報告中會包含樣品的檢測結果、數據分析以及結論等內容,供客戶進行后續操作和參考。 需要注意的是,辦理消毒劑檢測報告的流程可能因不同的檢測機構而有所差異。因此,在實際操作中,客戶應根據具體情況與檢測機構進行溝通和協商。同時,客戶也應提供真實有效的樣品和檢測需求,并遵守相關法規和規定,以確保檢測報告的準確性和有效性。
消字號安評報告的辦理流程可以歸納為以下幾個步驟: 一、準備申請資料 在申請消字號安評報告之前,需要準備一系列相關的申請資料。這些資料通常包括但不限于: 1. 產品標簽(銘牌)和說明書,應詳細描述產品的成分、使用方法、注意事項等,且標簽內容符合相關規定。 2. 產品配方,列出產品中的所有成分及其含量,并具體標明其投加量。 3. 生產企業衛生許可證,證明生產企業具備生產消毒產品的資質和條件。 4. 帶有CMA資質的檢驗報告,以及其他可能需要的證明文件,如營業執照、委托代加工協議等。 二、提交申請 將準備好的申請資料提交給責任單位所在地的衛生健康管理。這一步通常可以通過在線平臺或郵寄紙質材料完成。大部分地區都已實現線上提交,但部分地區可能還要求提供紙質版材料。 三、受理與資料審查 相關部門或機構在收到申請后,會對申請資料進行審查,確認資料是否、是否符合法定形式。如果資料不或不符合要求,將給予駁回,申請者可修改后再次提交直至審核通過為止。 四、實地勘察與樣品檢測 在資料審查通過后,相關部門或機構可能會派遣團隊到生產基地進行實地勘察,了解生產工藝、生產設備、生產環境等情況。同時,還會從生產線上隨機抽取產品樣品,并送往國家認可的實驗室進行嚴格的檢測。 五、編制安評報告與備案 根據實地勘察和樣品檢測的結果,相關部門或機構會編制詳細的衛生安全評價報告。報告內容通常包括產品質量評估、生產工藝優化建議等。隨后,該報告會被提交進行備案,確保產品符合相關的法規要求。 六、領取備案憑證或衛生許可批件 如果安評報告順利通過備案審核,申請者將在規定時間內(如5個工作日內)獲得衛生部門核發的備案憑證或衛生許可批件。這標志著消字號安評報告的辦理流程已完成,產品可以合法上市銷售。 請注意,以程可能因地區和產品類型的不同而有所差異。在實際操作中,建議咨詢當地衛生健康管理部門或機構以獲取準確的信息和指導。
一類和二類消毒產品備案的區別主要包括產品風險程度、備案有效期以及備案所需的關鍵項目檢驗等方面。以下是詳細的解釋: 1. **產品風險程度**: - 一類消毒產品:具有較高風險,需要嚴格管理以安全、有效。這類產品包括用于醫療器械的高水平消毒劑和消毒器械、滅菌劑和滅菌器械,皮膚黏膜消毒劑,生物指示物、滅菌效果化學指示物等。 - 二類消毒產品:具有中度風險,需要加強管理以安全、有效。這類產品包括除類產品外的消毒劑、消毒器械、化學指示物,以及帶有滅菌標識的滅菌物品包裝物、抗(抑)菌制劑等。 2. **備案有效期**: - 一類消毒產品:備案有效期為四年。在有效期滿前,產品責任單位應當重新進行衛生安全評價和備案。 - 二類消毒產品:備案長期有效,無需像一類產品那樣定期重新備案。 3. **備案所需的關鍵項目檢驗**: - 一類消毒產品:在重新備案時,需要對消毒產品進行檢驗,但只做關鍵項目。例如,消毒(滅菌)劑檢驗項目包括有效成分含量、pH值和一項抗力強的微生物殺滅試驗;消毒(滅菌)器械檢驗項目包括主要殺菌因子強度和一項抗力強的微生物殺滅試驗等。 - 二類消毒產品:雖然備案長期有效,但如果產品發生改變(如配方或結構、生產工藝變化),或者有相關規定中的其他情形,產品責任單位也應當及時更新衛生安全評價報告相關內容,并到原備案機關備案。這可能涉及對產品的某些關鍵項目進行檢驗,但具體要求可能不如一類產品嚴格。 總的來說,一類和二類消毒產品備案的主要區別在于產品的風險程度、備案的有效期以及備案過程中所需的關鍵項目檢驗。這些區別反映了不同類型消毒產品在安全性和有效性方面的不同要求,以及相應的管理策略。
抗(抑)菌制劑要做消字號備案的劑型主要包括以下幾種: 1. 液體:如抗菌洗劑和洗劑,這類產品直接接觸人體皮膚或黏膜,具有一定的殺菌或作用。其中,抗菌洗劑的殺滅率需大于或等于90%,而洗劑的率則需大于或等于50%。 2. 油劑:通常以礦油、動植物油、人工合成油等為原料,流動性好,外觀呈透明油狀液體,如潤膚油和按摩油。 3. 噴劑:如口腔清潔護理液(漱口水),通過含漱、噴灑或洗刷的方式,以清潔口氣、改善口腔衛生狀況。 4. 片劑:指原料或與適宜的輔料制成的圓形或異形的片狀固體制劑。 5. 粉劑:以粉體、香精、活性添加劑等為原料,經混合工藝制成的粉末狀產品,如護膚粉。 6. 膏劑、霜劑:以表面活性劑、增稠劑、穩定劑等為原料,經混合乳化工藝制成的不易流動的膏狀或霜狀產品,如潔面霜和洗發膏。 7. 凝膠:外觀透明或半透明的半固態膠凍狀制品,包括無水凝膠和水性凝膠兩類。 這些劑型都需要按照相關規定進行消字號備案,以確保產品的安全性和有效性。在備案過程中,需要提供產品說明書、生產工藝、檢驗報告等相關資料,并遵守國家藥品監督管理局的相關規定。請注意,具體備案要求可能因產品種類、用途和生產企業的不同而有所差異,因此建議在申請前仔細了解相關法律法規和標準規范的要求。
消毒產品衛生安全評價報告的辦理流程可以歸納為以下幾個步驟: 一、準備相關材料 在辦理消毒產品衛生安全評價報告前,需要準備以下相關材料: 1. 消毒產品衛生安全評價報告備案登記表。 2. 產品標簽(銘牌)和說明書。 3. 檢驗報告(含結論)。 4. 企業標準或質量標準。 5. 國產產品生產企業衛生許可證或進口產品生產國(地區)允許生產銷售的證明文件及報關單。 6. 如果是消毒器械,還需要提供結構圖(主要元器件及參數)。 此外,根據具體情況,可能還需要提供其他相關材料,如產品配方、委托檢驗協議、付款轉賬發票等。 二、選擇第三方評價機構 企業需要選擇一家具有相關資質和經驗的第三方評價機構進行衛生安全評價。這些機構通常是由國家認可的,并具備進行衛生安全評價的技術能力和資質。 三、提交產品資料并進行評估和測試 企業向選定的第三方評價機構提交產品的相關資料,包括上述準備的材料。評價機構會對這些資料進行評估和測試,以確保產品符合相關的衛生安全標準。評估和測試的內容可能包括產品的穩定性、安全性、有效性等。 四、編寫安全評價報告 在完成評估和測試后,評價機構會編寫消毒產品的安全評價報告。報告將全面評價產品的安全性和有效性,并包含產品的基本情況、測試結果、評估結論等內容。 五、提交備案申請 后,企業需要將安全評價報告提交至所在地的食品藥品監管部門或衛生和計劃生育進行備案申請。備案申請需要提供評價報告、生產企業的相關認證資料等。通過審核后,企業將獲得備案證書,表明其消毒產品已經通過了衛生安全評價。 需要注意的是,不同地區的消毒產品備案程序和要求可能會有所不同。因此,企業在進行消毒產品備案時,應與當地衛健委部門聯系,了解具體的備案要求和流程。

鄭州消毒產品檢測報告-消毒產品檢測報告
3000元
產品名:消毒產品檢測

涉水產品辦批件注意事項-河南辦涉水批件機構
7999元
產品名:涉水批件代辦,涉水產品批件,涉水產品檢測,涉水產品檢測辦批件

河南消毒產品許可證申辦流程-鄭州消毒衛生許可證辦理費用及周期
9999元
產品名:消毒許可證申辦流程,鄭州代辦消毒許可證,河南申辦消毒許可證,鄭州申辦消毒許可證
云南化妝品毒理試驗檢測三方機構-毒理試驗檢測中心
面議
產品名:動物毒理試驗檢測

重慶化妝品毒理試驗檢測三方機構-毒理試驗檢測中心
面議
產品名:動物毒理試驗檢測

寧夏消毒產品毒理試驗檢測三方機構-毒理試驗檢測中心
面議
產品名:動物毒理試驗檢測

貴州急性吸入毒性試驗檢測機構-動物毒理學檢測三方實驗室
面議
產品名:動物毒理試驗檢測

安徽多次皮膚刺激試驗檢測機構-動物毒理學檢測三方實驗室
面議
產品名:動物毒理試驗檢測